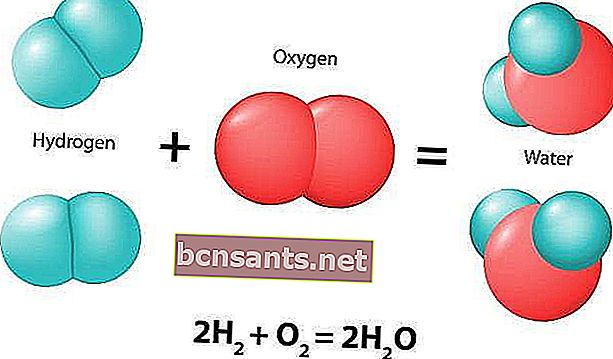
ปฏิกิริยาเคมีเป็นกระบวนการทางธรรมชาติที่ก่อให้เกิดการเปลี่ยนแปลงของสารประกอบทางเคมีอยู่เสมอ สารประกอบเริ่มต้นหรือสารประกอบที่เกี่ยวข้องกับปฏิกิริยาเรียกว่าสารตั้งต้น
ปฏิกิริยาเคมีมักมีลักษณะการเปลี่ยนแปลงทางเคมีและจะส่งผลให้เกิดผลิตภัณฑ์อย่างน้อยหนึ่งรายการซึ่งมักจะมีลักษณะแตกต่างจากสารตั้งต้น นี่คือตัวอย่างของปฏิกิริยาเคมี:
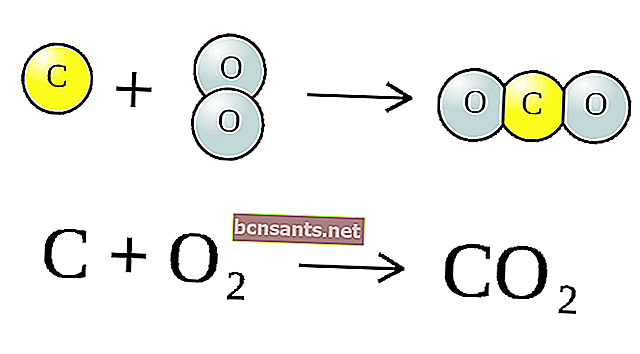
ปฏิกิริยาเคมีข้างต้นคือโมเลกุล (CO2) ซึ่งประกอบด้วยคาร์บอน 1 อะตอม (C) และออกซิเจน 2 อะตอม (O) บวกคาร์บอน (C) 1 อะตอมเพื่อผลิตคาร์บอนมอนอกไซด์ (CO) 2 อะตอม
การรวมกันของสัญลักษณ์เหล่านี้เรียกว่าสมการทางเคมี สารที่อยู่ทางซ้ายของลูกศรเรียกว่าต่อปฏิกิริยา (CO2) และ C และหลังจากลูกศรเรียกว่าผลิตภัณฑ์ปฏิกิริยาคือ CO
ลักษณะของปฏิกิริยาเคมี
ปฏิกิริยาเคมีในโลกแห่งความเป็นจริงนั้นหาได้ง่ายมากเช่นเมื่อเผากระดาษ กระดาษเริ่มต้นยังคงเป็นแผ่นสีขาวหลังจากเผาโดยใช้ไฟกระดาษสีจะไหม้

นอกจากนี้เมื่อเราต้มน้ำ น้ำที่เป็นของเหลวต่อไปจะกลายเป็นก๊าซและไอน้ำหลังจากต้มในหม้อที่วางบนเตา
เหตุการณ์เหล่านี้เป็นสัญญาณของปฏิกิริยาเคมีที่แท้จริง อย่างไรก็ตามสำหรับการก่อตัวของผลิตภัณฑ์ผลที่ได้นั้นยากมากที่จะเห็น นี่คือลักษณะของปฏิกิริยาเคมี:
1 . การเปลี่ยนสี
โมเลกุล / สารประกอบเคมีมีความสามารถในการดูดซับสีและเปล่งสีขึ้นอยู่กับสาร ความสามารถนี้อาจได้รับผลกระทบจากเหตุการณ์
ตัวอย่างเช่น: สารตั้งต้นของเหล็กที่ทิ้งไว้ในที่โล่งนานเกินไปและอยู่ในสภาพเปียกจะเกิดสนิม (สีเหลืองอมน้ำตาล)
2. การเปลี่ยนแปลงอุณหภูมิ
โมเลกุล / สารประกอบเคมีมีพลังงานภายในในรูปของพันธะเคมี พันธะเหล่านี้ต้องการพลังงานหรือสามารถปลดปล่อยพลังงานได้
เมื่อเกิดพันธะขึ้นมากมายพลังงานจะถูกปลดปล่อยออกมาเมื่ออุณหภูมิเพิ่มขึ้น ตัวอย่างเช่น: การเผาก๊าซ LPG บนเตา
3. ลักษณะของฟองก๊าซ
ก๊าซในปฏิกิริยาเคมีอาจเกิดขึ้นได้เนื่องจากความร้อน
ตัวอย่างเช่นโมเลกุล / สารประกอบของเบกกิ้งโซดาในแป้งเมื่อได้รับความร้อนจะปล่อยก๊าซออกมาเพื่อให้เค้กขยายตัว
4. การเปลี่ยนแปลงระดับเสียง
เมื่อผลิตภัณฑ์ที่เกิดจากปฏิกิริยาเคมีเกิดขึ้นนั่นหมายความว่าปริมาตรของสารตั้งต้นจะลดลง ตัวอย่างเช่นปริมาณน้ำในทะเลสาบลดลงในช่วงฤดูร้อน
5. ตะกอนก่อตัว
การตกตะกอนคือปฏิกิริยาทางเคมีที่ตกค้างระหว่างสารละลายสองตัวที่กลายเป็นของแข็ง สารนี้เกิดขึ้นได้เนื่องจากสารละลายอิ่มตัวเกินไป
ตัวอย่างเช่นสารละลายซิลเวอร์ไนเตรต (AgNO3) ถูกเติมลงในสารละลายที่มีโพแทสเซียมคลอไรด์ (KCl) ซึ่งจะเกิดการตกตะกอนของซิลเวอร์คลอไรด์ (AgCl) สีขาว
6. เปล่งแสง
ปฏิกิริยาเคมีบางครั้งปล่อยพลังงานออกมาในรูปของแสง
ตัวอย่างเช่นปฏิกิริยาต่อดวงอาทิตย์
7. การเปลี่ยนแปลงการนำไฟฟ้า
ปฏิกิริยาเคมีมีผลต่อการเปลี่ยนแปลงการนำไฟฟ้า (ความสามารถในการนำความร้อน)
8. รสชาติเปลี่ยนไป
ปฏิกิริยาทางเคมีเมื่อเคี้ยวข้าวจะทำให้เกิดรสหวานเมื่อสัมผัสลิ้น
ปัจจัยที่มีผลต่อ

อัตราการเกิดปฏิกิริยาหรือความเร็วในปฏิกิริยาเคมีระบุจำนวนปฏิกิริยาเคมีที่เกิดขึ้นต่อหน่วยเวลา
อัตรานี้ได้รับอิทธิพลจากปัจจัยหลายประการที่สามารถเร่งหรือชะลอกระบวนการเกิดปฏิกิริยาได้ นี่คือปัจจัย
1. การวัดสารตั้งต้น
เกลือหยาบหรือเกลือที่ยังเป็นก้อน เกลือหยาบนี้ละลายในน้ำได้ค่อนข้างช้าเนื่องจากมีขนาดใหญ่ ดังนั้นปฏิกิริยาเคมีจึงขึ้นอยู่กับขนาดของสาร
อ่านเพิ่มเติม: อุปสงค์และอุปทาน - คำจำกัดความกฎหมายและตัวอย่าง2. อุณหภูมิ
อุณหภูมิอาจส่งผลต่อปฏิกิริยาทางเคมีกล่าวคือโดยการให้ความร้อน ตัวอย่างเช่นในฤดูร้อนป่าไม้จะไหม้เร็วกว่าในช่วงฤดูฝน
3. ตัวเร่งปฏิกิริยา
ตัวเร่งปฏิกิริยาเป็นสารที่เร่งอัตราการเกิดปฏิกิริยาเคมีที่อุณหภูมิหนึ่งโดยไม่ต้องพบกับการเปลี่ยนแปลงหรือถูกใช้ไปโดยปฏิกิริยานั้นเอง เอนไซม์เป็นตัวเร่งปฏิกิริยาประเภทหนึ่ง หากไม่มีเอนไซม์ปฏิกิริยานี้จะช้าเกินไปสำหรับการเผาผลาญที่จะเกิดขึ้น
ตัวอย่างเช่นเอนไซม์มอลเตสจะแปลงมอลโตส (ชนิดของโพลีแซคคาไรด์หรือน้ำตาลเชิงซ้อน) เป็นน้ำตาลกลูโคสต่อไปนี้เป็นรูปแบบทั่วไปของปฏิกิริยาเร่งปฏิกิริยาโดยที่ C หมายถึงตัวเร่งปฏิกิริยา:
A + C → AC (1)
B + AC → AB + C (2)
ขั้นตอนการเกิดปฏิกิริยาเคมี
ขั้นตอนของปฏิกิริยาอาจแบ่งออกได้อย่างง่ายดาย:
- การยุติความสัมพันธ์
- การก่อตัวของสารทรานซิชัน
- การก่อตัวของพันธบัตร
สำหรับสารประกอบไบโมเลกุลขั้นตอนจะซับซ้อนมากขึ้นเนื่องจากปฏิกิริยาของธาตุ
- ขั้นตอนการเริ่มต้นปฏิกิริยา
- การยุติความสัมพันธ์
- การก่อตัวของสารทรานซิชัน
- การสร้างผลิตภัณฑ์
- การรักษาเสถียรภาพพลังงาน (โดยการดูดซับหรือปล่อยพลังงาน / โดยปกติจะให้ความร้อน)
เบ็ดเตล็ด
ปฏิกิริยาเคมีมีความหลากหลายมาก แต่สามารถแบ่งได้เป็นปฏิกิริยาหลายประเภท ได้แก่ :
1. ปฏิกิริยาการควบรวมกิจการ
ปฏิกิริยาของสารทั้งสองที่รวมกันเป็นสารใหม่ ตัวอย่างง่ายๆคือการก่อตัวของเกลือ NaCl: 2Na + Cl2 → 2NaCl
2. ปฏิกิริยาการสลายตัว
สารประกอบที่เกิดขึ้นในปฏิกิริยาเคมีแตกตัวออกเป็นสารมากกว่าสองชนิด ตัวอย่างคือการสลายตัวของน้ำ H2O: 2H2O → 2H2 + O2
3. ปฏิกิริยาการแลกเปลี่ยนเดียว
ปฏิกิริยาแลกเปลี่ยนคือปฏิกิริยาที่องค์ประกอบทำปฏิกิริยากับสารประกอบเพื่อแทนที่องค์ประกอบที่มีอยู่ในสารประกอบนั้น ตัวอย่างเช่นถ้าทองแดงแช่อยู่ในสารละลายซิลเวอร์ไนเตรตจะเกิดผลึกโลหะเงิน สมการของปฏิกิริยาคือ:
Cu (s) + 2AgNO 3 (aq) → 2Ag (s) + Cu (NO 3 ) 2 (aq)
4. ปฏิกิริยาการแลกเปลี่ยนหลายรายการ
โดยปกติเรียกว่าปฏิกิริยา metathesis เป็นปฏิกิริยาการแลกเปลี่ยนส่วนหนึ่งของสารตั้งต้น ถ้ารีเอเจนต์เป็นสารประกอบไอออนิกลอร์แทนชิ้นส่วนที่แลกเปลี่ยนคือไอออนบวกและแอนไอออนของสารประกอบ ตัวอย่างเช่นปฏิกิริยาของกรดกับเบสเช่น:
HCl (aq) + NaOH (aq) → NaCl (aq) + H 2 O (l)
5. ปฏิกิริยาการเผาไหม้
ปฏิกิริยานี้สามารถเรียกได้ว่าเป็นปฏิกิริยาในการจัดเรียงอะตอมใหม่ ทำเครื่องหมายว่าสารเคมีชนิดหนึ่งคือออกซิเจน
นั่นคือปฏิกิริยาการเผาไหม้เป็นปฏิกิริยาทางเคมีของสารกับออกซิเจนโดยปกติจะทำปฏิกิริยาเร็วขึ้นเมื่อปล่อยความร้อนจนกระทั่งเปลวไฟปรากฏขึ้น ตัวอย่างเช่นการเผาไหม้ก๊าซมีเทน
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g)
ตัวอย่างปฏิกิริยาเคมี
มีปฏิกิริยามากมายที่จะพบในชีวิตจริง บางคนมีเจตนาในรูปแบบของการฝึกปฏิบัติในห้องปฏิบัติการเพื่อให้เกิดขึ้นเองตามธรรมชาติ
ปฏิกิริยาเคมีเหล่านี้บางส่วนอาจรวมถึงปฏิกิริยาการรวมตัวเป็นผลิตภัณฑ์ใหม่การเผาไหม้การสลายตัวและอื่น ๆ นี่คือปฏิกิริยาทั่วไปบางส่วน:
1. การก่อตัวของสบู่

ปฏิกิริยาต้นอ่อนเป็นปฏิกิริยาไฮโดรไลซิสของไขมัน / น้ำมันโดยใช้ฐานที่แข็งแรงเช่น NaOH หรือ KOH เพื่อผลิตกลีเซอรอลและเกลือของกรดไขมันหรือสบู่ NaOH ใช้ในการผลิตสบู่แข็งในขณะที่ KOH ใช้ในการผลิตสบู่อ่อนหรือสบู่เหลว
ความแตกต่างระหว่างสบู่แข็งและสบู่อ่อนเมื่อดูจากความสามารถในการละลายในน้ำคือสบู่แข็งละลายในน้ำได้น้อยเมื่อเทียบกับสบู่อ่อน ปฏิกิริยาซาพอนิฟิเคชันเรียกอีกอย่างว่าปฏิกิริยาซาพอนิฟิเคชัน

2. ปฏิกิริยากรด - เบสต่อเกลือ
อ่านเพิ่มเติม: หลักภูมิศาสตร์ 4 ประการและการนำไปใช้ในชีวิตของเราในทางเคมีเกลือเป็นสารประกอบไอออนิกซึ่งประกอบด้วยไอออนบวก (ไอออนบวก) และไอออนลบ (แอนไอออน) ซึ่งเป็นสารประกอบที่เป็นกลาง (โดยไม่ต้องมีประจุ) เกลือเกิดจากปฏิกิริยาของกรดและเบส เกลือยังสามารถเกิดขึ้นจากเกลือสองชนิดที่แตกต่างกันเช่น:
Pb (ไม่3 ) 2 (aq) + Na 2 SO 4 (aq) → PbSO 4 (s) + 2 NaNO 3 (aq)
3. ปฏิกิริยาการกัดกร่อน
การกัดกร่อนคือความเสียหายของโลหะเนื่องจากปฏิกิริยารีดอกซ์ระหว่างโลหะกับสารต่างๆในสิ่งแวดล้อมซึ่งก่อให้เกิดสารประกอบที่ไม่ต้องการ
ในกระบวนการกัดกร่อนเหล็ก (Fe) ทำหน้าที่เป็นตัวรีดิวซ์และออกซิเจน (O2) ที่ละลายในน้ำจะทำหน้าที่เป็นตัวออกซิไดเซอร์ สมการปฏิกิริยาสำหรับการก่อตัวของสนิมมีดังนี้:
Fe ( s ) → Fe2 + ( aq ) + 2e–
O 2 ( กรัม ) + 4H + ( AQ) + 4e- → 2H 2 O ( L )
4. ปฏิกิริยาการสังเคราะห์ด้วยแสง
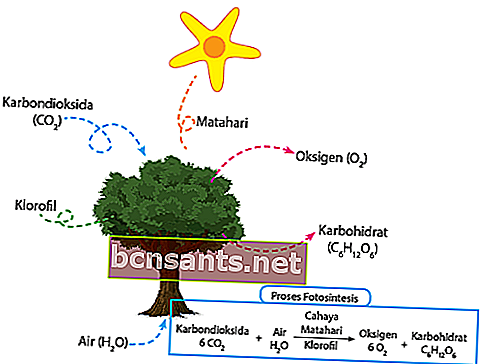
ตาม KBBI กระบวนการสังเคราะห์ด้วยแสงเป็นพืชสีเขียวที่ใช้แสงแดดในการเปลี่ยนน้ำและคาร์บอนไดออกไซด์เป็นคาร์โบไฮเดรต ก๊าซคาร์บอนไดออกไซด์ที่อยู่รอบ ๆ พืชจะถูกดูดซึมโดยตรงผ่านเนื้อเยื่อปากใบในใบ น้ำรอบ ๆ พืชจะถูกดูดซึมโดยตรงทางรากและส่งผ่านไปยังใบผ่านลำต้นของพืช
ในตอนเที่ยงความเข้มของแสงที่ตกลงมาจะถูกจับโดยตรงโดยคลอโรฟิลล์เพื่อสังเคราะห์แสง พลังงานจากแสงแดดที่ถูกจับก่อนหน้านี้จะเปลี่ยนน้ำเป็นออกซิเจนและไฮโดรเจนทันที
ในที่สุดไฮโดรเจนที่ได้รับจะถูกรวมเข้ากับคาร์บอนไดออกไซด์โดยตรงเพื่อผลิตอาหารสำหรับความต้องการของพืชเหล่านี้ ส่วนที่เหลือออกซิเจนจะถูกปล่อยออกสู่อากาศโดยตรงผ่านปากใบ นี่คือสมการทางเคมี:
6CO2 + 6H2O + แสง = C6H12O6 + 6O2
5. ปฏิกิริยาทางเคมีของน้ำส้มสายชูและเบกกิ้งโซดา
คุณเคยได้รับการสอนเกี่ยวกับปฏิกิริยาทางเคมีว่าน้ำส้มสายชูและเบกกิ้งโซดาสามารถทำให้ภูเขาไฟระเบิดในโรงเรียนของคุณได้หรือไม่?
สารประกอบที่เป็นกรดผสมกับสารประกอบอัลคาไลน์จะทำให้เกิดสารประกอบที่เป็นกลาง ในการทดลองสารประกอบกรดอ่อนผสมในสารละลายกรดอะซิติก (CH3COOH) กับสารประกอบที่เป็นเบสแก่ในสารละลายเบกกิ้งโซดา (NaHCO3)

ในปฏิกิริยาทางเคมีสารอย่างน้อยหนึ่งชนิดสามารถเปลี่ยนเป็นสารใหม่ได้ตามการทดลองน้ำส้มสายชูกรด (CH3COOH) ทำปฏิกิริยากับเบกกิ้งโซดา (NaHCO3) เพื่อผลิตก๊าซ CO2
หากน้ำส้มสายชูกรด (CH3COOH) และเบกกิ้งโซดา (NaHCO3) ทำปฏิกิริยาจะทำให้เกิดฟองที่ทำให้เกิดก๊าซคาร์บอนไดออกไซด์ (CO2) ก๊าซและของเหลวเหล่านี้จะทำให้ของเหลวเช่นลาวาหลุดออกมา
6. ปฏิกิริยาเคมีของเอนไซม์
เอนไซม์เป็นสารชีวโมเลกุลในรูปแบบของโปรตีนที่ทำหน้าที่เป็นตัวเร่งปฏิกิริยา (สารประกอบที่เร่งกระบวนการปฏิกิริยาโดยไม่ทำปฏิกิริยาอย่างสมบูรณ์) ในปฏิกิริยาเคมีอินทรีย์
แม้ว่าสารประกอบตัวเร่งปฏิกิริยาสามารถเปลี่ยนแปลงได้ในปฏิกิริยาเริ่มต้นในปฏิกิริยาสุดท้ายโมเลกุลของตัวเร่งปฏิกิริยาจะกลับสู่รูปร่างเดิม เอนไซม์ทำงานโดยทำปฏิกิริยากับโมเลกุลของสารตั้งต้นเพื่อผลิตสารประกอบระดับกลางผ่านปฏิกิริยาอินทรีย์ซึ่งต้องการพลังงานกระตุ้นที่ต่ำกว่าเพื่อให้ปฏิกิริยาเคมีเร่งขึ้นเนื่องจากปฏิกิริยาทางเคมีที่มีพลังงานกระตุ้นสูงจะใช้เวลานานขึ้น
ตัวอย่างเช่น: เอนไซม์คาตาเลสเป็นเอนไซม์ที่เร่งปฏิกิริยาที่ไฮโดรเจนเปอร์ออกไซด์ถูกย่อยสลายเป็นน้ำและออกซิเจน
