
ระบบธาตุคือการจัดเรียงที่แสดงถึงองค์ประกอบทางเคมี โดยปกติระบบธาตุเป็นระยะจะจัดเรียงในรูปแบบตาราง
การจัดเรียงของระบบธาตุเป็นไปตามเลขอะตอมการกำหนดค่าอิเล็กตรอนและคุณสมบัติทางเคมี
ต่อไปนี้คือการจัดเรียงของระบบธาตุ:
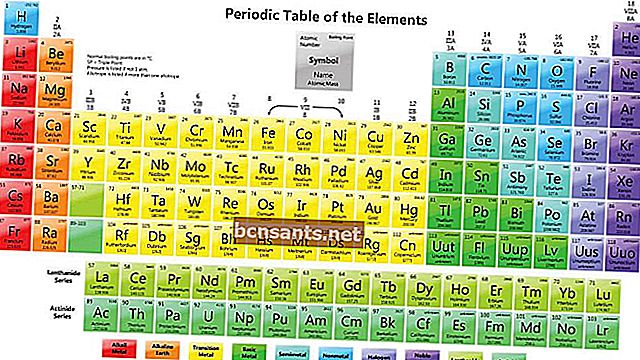
วิธีอ่านองค์ประกอบในระบบธาตุ
ที่ SPU คุณจะพบการเขียนของแต่ละองค์ประกอบดังที่แสดงด้านล่าง
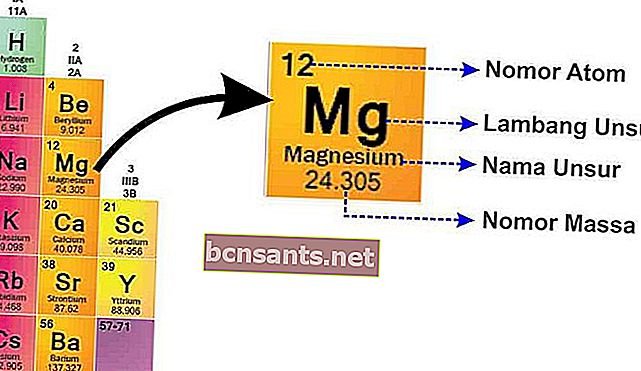
จากภาพนี้สามารถอธิบาย:
- จำนวนมวล
เลขมวลคือนิวเคลียสของอะตอมซึ่งมีประจุบวกเนื่องจากมีโปรตอนที่มีประจุบวกและนิวตรอนซึ่งเป็นกลาง
- เลขอะตอม
เลขอะตอมบอกจำนวนโปรตอนเนื่องจากอะตอมเป็นกลางเลขอะตอมจะบอกจำนวนอิเล็กตรอนด้วย
การจัดกลุ่มองค์ประกอบ
ในระบบธาตุแต่ละองค์ประกอบจะถูกจัดกลุ่มตามลำดับ
- กลุ่ม
กลุ่มต่างๆอยู่ในคอลัมน์แนวตั้งของตารางระบบธาตุ องค์ประกอบที่อยู่ในกลุ่มเดียวกันจะมีการกำหนดเวเลนซ์อิเล็กตรอนแบบเดียวกัน

- ระยะเวลา
คาบคือองค์ประกอบที่อยู่ในแถวแนวนอนบนตารางระบบธาตุ ระยะเวลาที่แสดงให้เห็นว่าพลังงานไอออไนซ์ , รัศมีอะตอมอิเล็กตรอนสัมพันธ์ที่ใกล้ชิดและอิเล็ก

- บล็อก
บล็อกแสดงถึงชุดขององค์ประกอบที่มีเวเลนซ์อิเล็กตรอนชั้นล่างเหมือนกัน

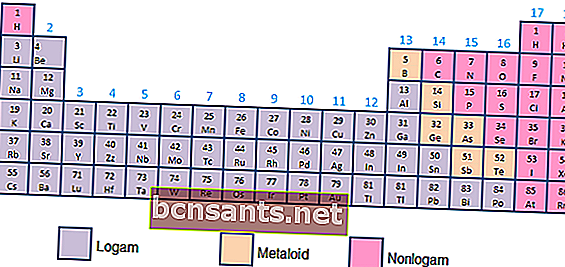
- โลหะโลหะผสมและอโลหะ
ขึ้นอยู่กับคุณสมบัติทางเคมีและทางกายภาพองค์ประกอบสามารถแบ่งได้เป็นโลหะ (การนำไฟฟ้าสูง), โลหะผสม (การนำไฟฟ้าระหว่างโลหะและอโลหะ) หรืออโลหะ (ไม่มีคุณสมบัติในการนำไฟฟ้าในรูปของก๊าซ)
พลังงานไอออไนเซชันรัศมีอะตอมความสัมพันธ์ของอิเล็กตรอนและค่าอิเล็กโทรเนกาติวิตี
พลังงานไอออไนเซชันรัศมีอะตอมความสัมพันธ์ของอิเล็กตรอนและค่าอิเล็กโทรเนกาติวิตีสามารถมองเห็นได้ตามคาบและกลุ่มของธาตุในระบบธาตุ
อ่านเพิ่มเติม: คุณระบุศพของเหยื่อเครื่องบินตกได้อย่างไร?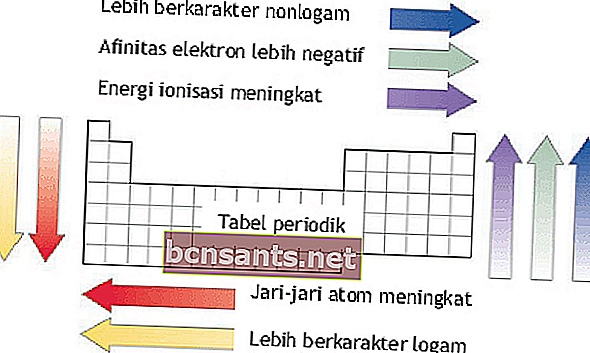
พลังงานไอออไนเซชัน
พลังงานไอออไนเซชันเป็นพลังงานที่จำเป็นในการกำจัดอิเล็กตรอนวงนอกหนึ่งตัวออกจากอะตอมในสถานะก๊าซ
ในช่วงเวลาหนึ่งพลังงานไอออไนเซชันจะเพิ่มขึ้นจากซ้ายไปขวาเมื่อเลขอะตอมเพิ่มขึ้น
ภายในกลุ่มพลังงานไอออไนเซชันจะลดลงจากบนลงล่างเมื่อเลขอะตอมเพิ่มขึ้น
รัศมีอะตอม
รัศมีอะตอมคือระยะห่างระหว่างนิวเคลียสและวิถีวงนอกสุดของอะตอม
ในช่วงเวลาหนึ่งรัศมีอะตอมจะเพิ่มขึ้นจากบนลงล่าง
ภายในกลุ่มรัศมีอะตอมจะเพิ่มขึ้นจากขวาไปซ้าย
ความสัมพันธ์ของอิเล็กตรอน
ความสัมพันธ์ของอิเล็กตรอนคือพลังงานที่อะตอมปล่อยออกมาในสถานะก๊าซเพื่อสร้างไอออนลบ
ในช่วงเวลาหนึ่งความสัมพันธ์ของอิเล็กตรอนจะเพิ่มขึ้นจากล่างขึ้นบน ภายในกลุ่มความสัมพันธ์ของอิเล็กตรอนจะเพิ่มขึ้นจากซ้ายไปขวา
อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตีคือค่าของแนวโน้มของอะตอมในการดึงดูดอิเล็กตรอนในการสร้างพันธะเคมี คุณสมบัตินี้มีความสำคัญในการสร้างพันธะระหว่างอะตอม
ในช่วงเวลาหนึ่งค่าอิเล็กโทรเนกาติวิตีจะเพิ่มขึ้นจากล่างขึ้นบน
ในช่วงเวลาหนึ่งค่าอิเล็กโทรเนกาติวิตีจากซ้ายไปขวาจะเพิ่มขึ้น
ข้อมูลอ้างอิง
- ตารางธาตุ
- //www.studiobelajar.com/sistem-periodic-elements/
